天津工业生物技术研究所等发现一种基于超氧阴离子的过氧化氢酶催化机制
字号:【大】 【中】 【小】
过氧化氢酶是一种普遍存在于自然界的血红素铁酶,其活性主要是分解H2O2产生H2O和O2,以保护生物体不被过氧化氢所毒害,目前该酶的主要研究方向为H2O2的分解机制及其生理功能,而过氧化氢酶的O2的代谢利用机制尚未见报道。前期研究发现,过氧化氢酶EasC利用O2催化麦角生物碱核心骨架四并环结构中C环合成时并不需要额外添加NADPH等还原剂,推测其可能代表着一种未知的氧气激活与氧同化机制。
近日,中国科学院天津工业生物技术研究所高书山团队与杭州师范大学郭瑞庭团队合作,破解了EasC蛋白底物复合体结构,并利用波谱测定、体外生化、同位素标记和化学计算等手段,从分子水平阐明了EasC利用O2催化氧化环化反应的新机制。团队首先通过电镜获得EasC酶与底物PCC的复合体结构(2.33 Å),发现EasC呈现二聚体结构,并且发现PCC并不是结合在heme口袋上方,而是结合在过氧化氢酶共有的NADPH口袋,该位置距离heme口袋20.7 Å,两口袋之间通过一个狭长活性氧传输通道相连。为了探究EasC参与催化反应的铁氧复合物类型,随后团队对酶的波谱特征进行了检测。在有氧条件下,将底物PCC和EasC酶(静息态Fe(III))进行快速混合,使用停留色谱检测到了416、 544 和590 nm 的最大吸收,该吸收明显区别于血红素酶已报道的铁-氧复合体Compound I (Cpd I,Fe(IV)=O) 的最大吸收(408 和650 nm),反而与文献报道的Compound III(Cpd III,Fe(III)-O2•-)吸收一致,表明EasC中的血红素铁可能以Cpd III的方式参与催化反应。进一步的电子顺磁共振和紫外吸收测试表明,在有氧条件下,静息态EasC的Fe(III)接收底物电子并与O2结合耦合、直接形成Cpd III。由于Cpd III可以分解生成超氧阴离子(O2•-)并回归到静息态Fe(III),团队推测EasC催化过程可能由超氧阴离子介导。因此该研究进一步通过活性氧抑制实验、超氧阴离子恢复实验以及18O标记的超氧阴离子自由基竞争性实验,鉴定出氧气被活化成超氧阴离子(O2•-)的活性氧形式、参与底物的转化,而非传统的铁-氧复合物转化底物。
基于以上实验结果,团队提出了基于活性氧超氧阴离子的反应机制:i)结合在NADPH口袋的底物PCC,其吲哚氨基将一个电子传递给血红素口袋的Fe(III),后者同时和氧气结合形成Fe(III)-O2•- (Cpd III);ii)Cpd III进一步分解成Fe(III)和超氧阴离子(O2•-),生成的超氧阴离子通过两个口袋之间的ROS通道进入NADPH口袋;iii)超氧阴离子与底物PCC结合,催化复杂的氧化环化反应,完成麦角生物碱C环的合成。
综上所述,该研究详细阐明了麦角生物碱核心骨架C环的生物合成机制,发现过氧化氢酶EasC利用超氧阴离子实现氧气激活,并进一步催化氧化环化反应。该机制代表了一种全新的血红素金属酶的催化模式,即氧气无需形成活性铁-氧复合物。同时,该研究也让过氧化氢酶的相关研究从H2O2依赖性酶转向O2依赖性酶,拓展了过氧化氢酶这一生物催化剂的研究领域。
该工作得到了国家重点研发计划、国家自然科学基金、天津市合成生物技术创新能力提升行动、湖北红山实验室项目、杭州师范大学交叉学科研究项目以及中国科学院战略性先导科技专项等项目支持,相关成果发表于Nature期刊。杭州师范大学陈纯琪教授、博士生刘紫薇,中国科学院天津工业生物技术研究所客座博士生禹之璞、中国科学院微生物研究所副研究员姚永鹏为本文的共同第一作者,高书山研究员和郭瑞庭研究员为本文的共同通讯作者。低碳合成工程生物学全国重点实验室和工业酶国家工程研究中心相关科研人员在本项工作中做出了重要贡献。
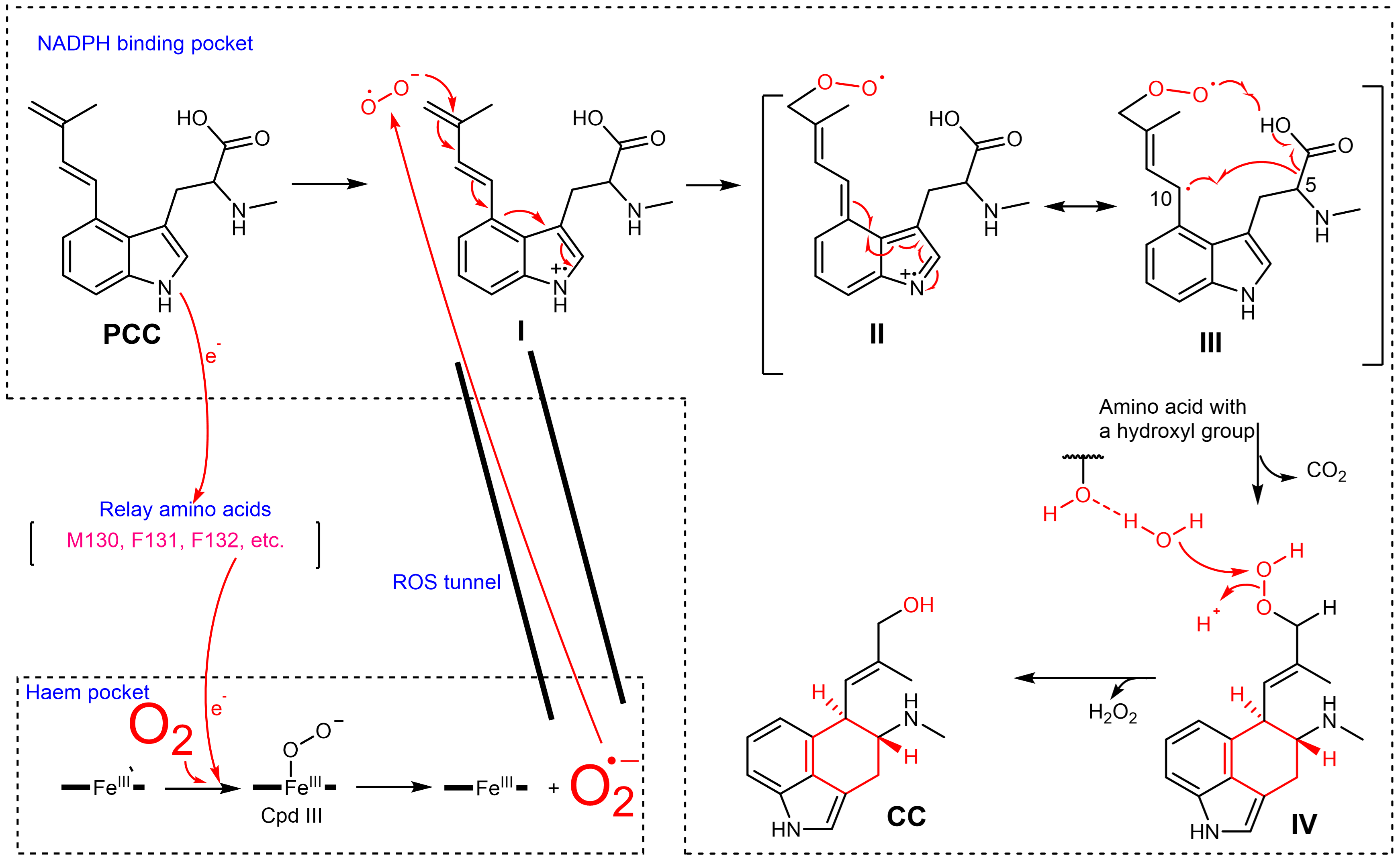
超氧阴离子(O2•-)催化麦角生物碱C环的合成机制
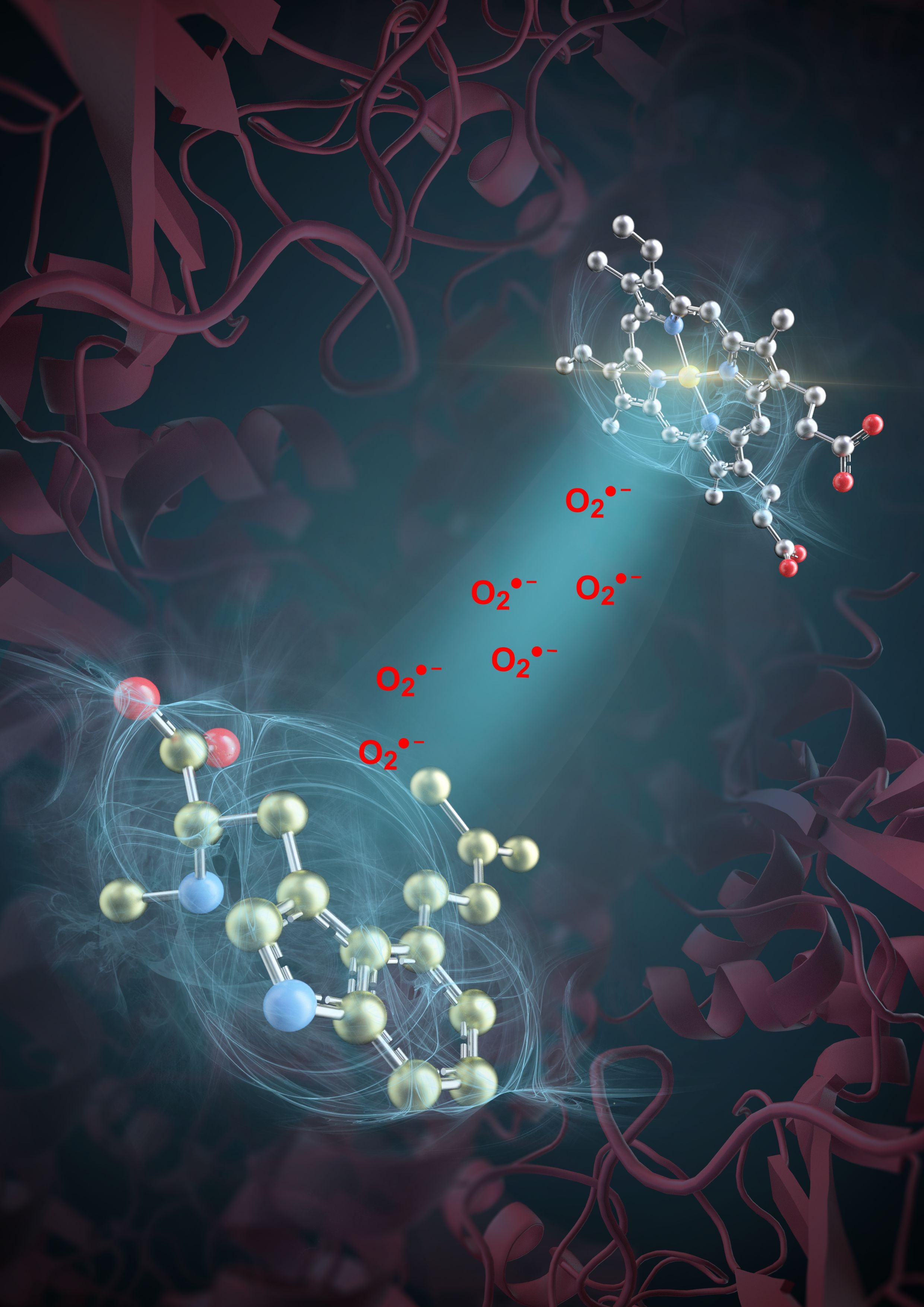
过氧化氢酶生成超氧阴离子催化麦角碱天然药物分子生物合成示意图
专家点评:
赵国屏(中国科学院院士,中国科学院合成生物学重点实验室专家委员会主任)
超氧阴离子(O₂•⁻)是在细胞代谢中产生的一种活性氧自由基,通常认为它具有损伤DNA、蛋白质等生物毒性功能。另一方面,超氧阴离子在化学合成中已经作为一种化学催化剂广泛用于有机分子合成;那么,超氧阴离子是否可能在生物催化、生物合成中发挥作用,尚未得到揭示。近期,高书山课题组和郭瑞庭课题组合作,在体外催化实验中发现超氧阴离子参与天然产物分子的生物合成,并解析其机制;这一新的认识,突破了超氧阴离子现有的毒性功能认知。
在此项研究中,研究者综合结构生物学、生物化学、同位素化学以及波谱学实验,发现过氧化氢酶EasC可以利用麦角生物碱底物提供的一个电子,在血红素口袋直接将氧气还原成超氧阴离子;后者可以进一步通过超氧阴离子传递通道,输送至位于蛋白表面的底物反应位点,催化复杂、多步的自由基反应,合成麦角生物碱天然产物分子。文章进一步指出,这种由活性氧介导的生物催化机制极可能普遍存在于自然界,是一种普遍存在的金属酶催化机制。因此,本研究不仅解析了过氧化氢酶EasC的一种特别有趣的前所未知的催化机制,更重要的是界定了超氧阴离子的生物催化功能。它向人们揭示了超氧阴离子在生命活动中的双重功能特性,即既是细胞代谢中不可避免会产生的具有毒性的副产物,又可能在生物合成过程中成为催化工具、参与天然产物合成;从而提示人们应全面认识超氧阴离子的作用,并根据不同的应用场景,注意恰当的防护或利用。
邓子新(中国科学院院士,上海交通大学微生物代谢全国重点实验室主任)
在微生物细胞内,O2需要在氧化酶/加氧酶的激活下,作为亲电试剂通过酶促反应整合至代谢产物的含氧官能团(如羟基、羰基等)中、产生特定生物功能的结构单元。常见的氧化酶O2激活路径为:酶结构中的有机辅酶或金属辅因子利用还原剂的电子还原O2、形成辅酶-O复合体/辅因子-O复合体;上述复合体进一步来催化底物的氧化/加氧等生物化学反应。这一典型O2激活路径被学术界广泛认可,在教科书中关于酶的催化机制阐释中被广泛引用。
高书山课题组和郭瑞庭课题组合作,围绕真菌天然药物麦角生物碱合成酶EasC的生物催化机制解析,捕获到一种新O2活化机制。该机制由三部分组成,第一,底物直接为血红素Fe(III)供电子,彻底摆脱对NADPH的依赖;第二,通过Fe(III)-O₂•⁻中间体的瞬时生成,将危险的超氧阴离子(O₂•⁻)转化为可控的催化"手术刀";第三,疏水传输通道确保活性氧分子精准导航至底物反应位点。此种O2激活模式下的EasC酶利用超氧阴离子作为自由扩散型催化工具,成功解耦过氧化氢酶生化反应的空间限域性。
这种基于超氧阴离子的O2激活模式突破了传统酶促氧代谢的辅酶-O/辅因子-O等复合体催化理论框架。这一发现证明了自然界血红素酶等金属酶催化的功能和机制的多样性,为人工设计高效生物催化剂开辟全新路径,在生物制药、绿色化工等领域具有重大应用潜力。
李盛英(山东大学教授)
血红素酶是自然界中含量最丰富且功能最多样的生物催化剂之一,其介导的氧化反应在细胞外源物降解、代谢产物生物合成中发挥着核心关键作用。由于大气中的O₂分子处于热力学稳定态,其直接参与生物合成反应存在显著动力学势垒,因此对于血红素酶催化的氧化反应过程可以分为两个阶段:O2激活和底物转化。在NADPH提供电子的前提下,酶通过血红素铁激活还原O2,形成Fe-O复合物(Compound I/II/III),进而转化底物。这种铁-O复合物模式要求底物结合于血红素上方,且氧气激活与底物转化发生在同一口袋,这种"面对面"的工作模式,严重限制了复杂分子的合成空间。
近期,中国科学院天津工业生物技术研究所高书山团队与杭州师范大学郭瑞庭团队在《自然》发表的成果揭示了一种双口袋、远程协同催化模式。在该研究中,高书山团队和郭瑞庭团队合作,通过冷冻电镜解析了麦角生物碱合成酶EasC的复合物结构,发现麦角生物碱底物结合于NADPH口袋而非传统血红素口袋,并通过一个狭长的疏水隧道实现血红素口袋与底物口袋的协同催化。通过停流光谱、EPR以及紫外-可见光谱等技术证实了血红素-铁的Compound III(Cpd III)中间体的存在,并创新性地提出Cpd III可以分解生成超氧阴离子(O₂•⁻),后者通过隧道传递介导麦角生物碱C环形成的自由基级联反应。
这种机制相当于在针尖上建起两座不同化工厂,分别生产活性氧和药物分子,并通过分子级"特快专列"传递催化指令。在该机制中,底物无需直接接触Fe中心与O2,O2激活与底物转化分别在独立区域完成。这种空间分离不仅显著扩展了底物转化的三维空间,还实现了多步自由基氧化环化反应的精准调控。因此,该研究发现突破了血红素酶传统的Fe-氧复合物催化范式,为自然界广泛存在的血红素酶催化机制研究提供了新视角。
陈义华(中国科学院微生物研究所研究员,微生物资源与生物技术研究室主任)
微生物次级代谢蕴藏了丰富的化学结构多样性,是抗生素、抗癌药物、免疫调节剂等药物分子的重要来源。为了合成结构各异的次级代谢产物,微生物进化出了突出的酶催化元件多样性。对微生物药物分子的生物合成研究有效拓展了酶催化机制的认知边界,为开发新型酶元件和发展合成生物学技术奠定了基础。
高书山团队前期在对麦角生物碱类药物的研究中发现了特殊的过氧化氢酶EasC,它可以催化裸麦角碱C环的形成。在Nature最新发表的工作中,他们和郭瑞庭团队合作进一步揭示了EasC的独特催化机制,拓展了对氧化酶催化机制的认知边界。EasC突破了经典过氧化氢酶仅催化H₂O₂歧化的功能局限,进化出了一种前所未知的超氧阴离子(O₂•-)介导的协同催化机制,催化形成了裸麦角碱的C环。
EasC对氧化还原酶经典催化机制的挑战在于:它并非利用活性的血红素Fe-O复合物来催化反应,而是在血红素活化区分解血红素Fe和氧气形成的Compound III产生超氧阴离子,通过11.6Å的疏水隧道扩散至底物转化区完成裸麦角碱的氧化环合。这种"自由基穿梭"机制为理解金属酶催化中的电子-活性氧协同传递催化提供了全新的视角。更有意思的是,EasC采用的"双位点-隧道协同"的催化架构展现了微生物在利用有限的氧活化反应类型的基础上,进化出的催化智慧:通过血红素在活化区产生活性氧物种(ROS),在空间解耦的底物转化区完成催化。将ROS的生成与利用进行空间区室化,既避免了细胞毒性,又高效完成了氧化反应,展现了酶对多步自由基级联反应的精准时空调控。
微生物次级代谢产物生物合成研究的突破不断刷新我们对生物催化的认知。不管是前期发现的不依赖任何辅基的氧化酶、不同类型的卤化酶、Diels–Alder环化酶,还是该研究揭示的新型过氧化氢酶,都为认识生物催化的多样性、开发新型生物催化剂、重构药物分子生物合成途径提供了宝贵的资源。
版权所有 © 2012- Copyright All Rights Reserved 中国科学院天津工业生物技术研究所 版权所有
通讯地址:天津空港经济区西七道32号,邮编:300308
电话:022-84861997/84861977,传真:022-84861926,邮箱:tib_zh(AT)tib.cas.cn