结核病(Tuberculosis,TB)是由结核分枝杆菌(M. tuberculosis,Mtb)引起的一种传染性疾病。目前全球每年新增结核病例约1000万,约120万人死于该病。多重耐药和广泛耐药Mtb的出现和传播给结核病的防控和治疗带来巨大挑战。
Mtb产生耐药的机制有多种,除了药物靶点突变外,外排泵介导的药物外排也是耐药性产生的重要原因之一。EfpA是Mtb中鉴定到的首个MFS(facilitator superfamily)家族外排泵,它在Mtb的生命代谢活动中起着关键作用。多项研究表明EfpA的高表达与异烟肼、利福平、乙硫异烟胺、阿米卡星和氟喹诺酮等多种药物的耐药性有关。靶向EfpA的小分子抑制剂可以有效杀灭Mtb,表明EfpA是一个具有潜力的抗结核药物新靶点。然而EfpA本身的生物学功能以及它引起耐药的分子机制还不清楚。
近日,中国科学院天津工业生物技术研究所蛋白质工程与疫苗研究团队和山西高等创新研究院、中国科学院深圳先进技术研究院等研究团队,通过冷冻电镜解析了EfpA的结构,分辨率达到2.9 Å。结构显示,EfpA由两个单体组装成反向二聚体,每个单体由14个跨膜螺旋组成,两个单体都呈“向外开放”(“outward-facing”)构象。在EfpA二聚体中,可以清楚地观察到多个脂分子。通过液相色谱-质谱分析,鉴定出多种脂分子存在于重组EfpA蛋白,其中磷脂酸PA与电镜结构分析的结果匹配最高。EfpA的两个关键氨基酸,S191和T324通过极性相互作用参与识别磷脂的头部,而CTD结构域上的疏水空腔则容纳了磷脂的脂肪酸链。磷脂翻转实验进一步表明,EfpA具有脂质转运功能,而小分子药物BRD-8000.3能够抑制其转运活性。
通过解析EfpA与BRD-8000.3的复合物结构,研究发现两个BRD-8000.3分子共同占据了EfpA二聚体之间的脂质结合位点。已有文献报道表明,V319F突变使得BRD-8000.3对EfpA失去抑制效果。本研究进一步发现,V319F突变重组蛋白的表达量较野生型重组蛋白提升了10倍以上,且其组装形式发生了显著变化。这种由V319F突变引起的构象变化和表达量升高,可能正是BRD-8000.3对其抑制失效的关键原因。
该研究首次阐明EfpA是一个脂质转运蛋白,并提出一个全新的转运脂质模型;揭示了EfpA引起耐药的分子机理,为新药研发提供了结构基础。
该研究工作得到国家自然科学基金、天津市合成生物技术创新能力提升行动和中国博士后科学基金资助。相关研究成果发表于PNAS期刊。中国科学院天津工业生物技术研究所高峰研究员、校海霞研究员,中国科学院微生物研究所高福院士为本文的共同通讯作者。。
论文链接
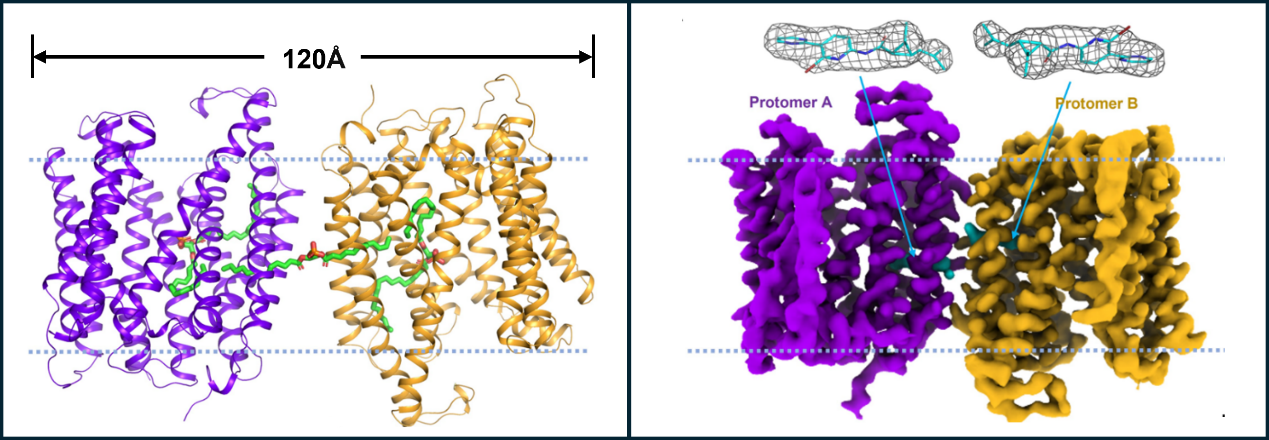
结核分枝杆菌外排泵EfpA蛋白和脂质以及和抑制剂复合物结构
