在基因组和转录组水平上基于CRISPR/Cas9技术驱动的各种基因编辑技术发展迅速,但是作为遗传信息的最终执行者,蛋白质的编辑技术研究尚处于萌芽阶段。是否可以通过开发创新的技术手段来实现精确的蛋白质编辑和功能研究,亟需更多探索。
中国科学院天津工业生物技术研究所田朝光带领的真菌合成生物学研究组开发了一种针对N-糖基化蛋白靶向编辑技术,实现了在哺乳动物细胞中直接编辑目标蛋白的N-糖基化氨基酸位点。通过整合高亲和力小肽和不同物种来源的肽:N-糖苷酶(简称为PNGase),同步实现目标糖蛋白N-糖链的去除和蛋白质氨基酸序列编辑(天冬酰胺Asn天冬氨酸Asp)。该研究选择了三种膜蛋白质(程序性细胞死亡蛋白-1 [PD-1]、程序性细胞死亡蛋白-1配体1 [PD-L1]、严重急性呼吸综合征冠状病毒2 [SARS-COV-2]刺突蛋白Spike protein)作为测试对象。在哺乳动物活细胞内,来源于米氏伊丽莎白假单胞菌(Elizabethkingia miricola)的高活性PNGase F(简称为PNGF)能够有效去除三种目标糖蛋白的天冬酰胺残基的 N-糖链,并将该位点编辑为天冬氨酸。酿酒酵母(Saccharomyces cerevisiae)来源的截短的PNG1 (简称为ScPNG1ΔH1) 对哺乳动物细胞内表达的天然 N-糖蛋白也具有一定的活性。去糖基化脱酰胺编辑普遍破坏了目标糖蛋白 PD-1,PD-L1 和 Spike 的蛋白质稳定性,加速了其依赖于蛋白酶体途径的降解过程。在融合了对Spike蛋白具有高亲和力的小肽 LCB1 后,LCB1-PNGF 和 LCB1-ScPNG1ΔH1 对于目标 Spike 蛋白均发挥出了更优的编辑效果,说明靶向肽增强了编辑特异性。最终,LCB1-PNGF 编辑器成功实现了对新冠病毒 Spike 蛋白N-糖基化位点的特异性编辑,显著降低合胞体的形成并且极大地抑制了假病毒侵染宿主效率。
生物体内含有大量的具有 N-糖基化修饰的蛋白,这种翻译后修饰在多种生物学功能中起着至关重要的作用,包括蛋白质折叠和稳定性、细胞间通信、膜蛋白质运输、病原体入侵以及免疫反应等。这种蛋白质靶向编辑技术的开发为探索蛋白质N-糖基化修饰功能提供了创新的技术手段,同时为新型蛋白质降解技术的开发提供了新的视角。
该研究工作得到国家重点研发计划的支持。研究成果已在hLife期刊发表。中国科学院天津工业生物技术研究所博士后武敏和科研助理白桂杰为论文共同第一作者,田朝光研究员为论文通讯作者。
论文链接
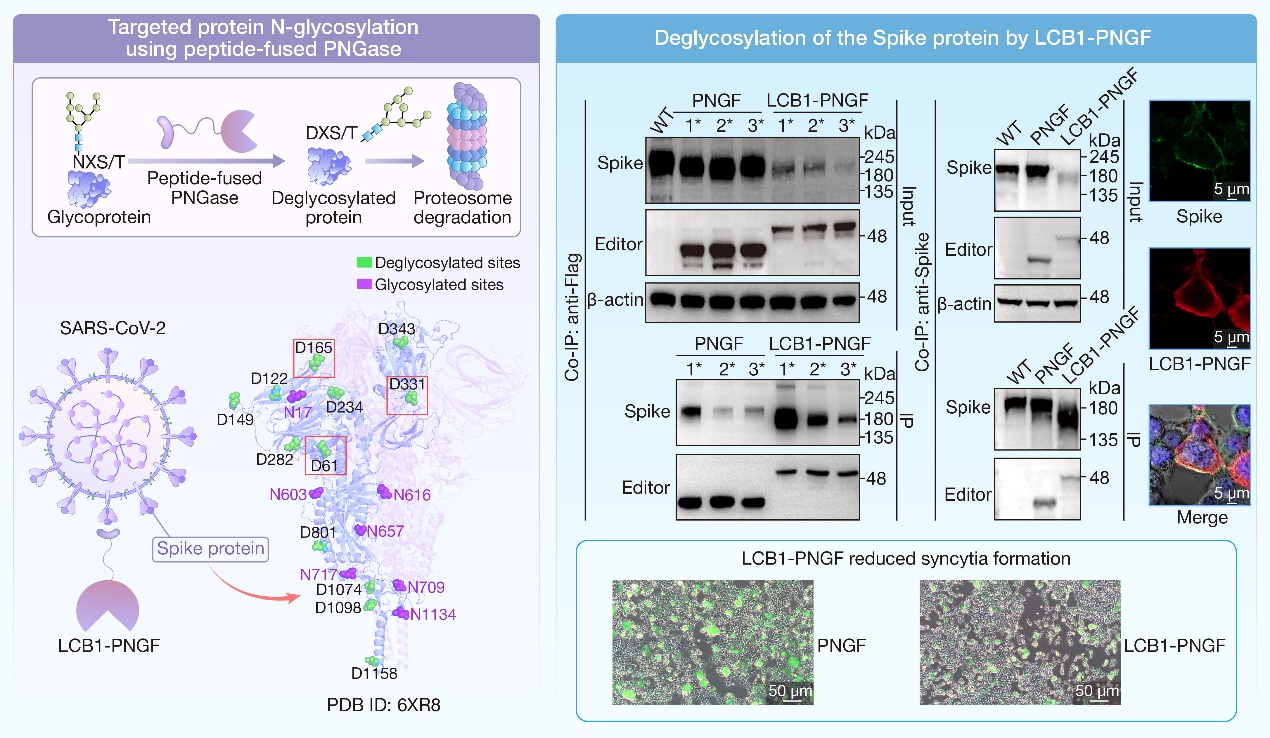
蛋白质靶向编辑器LCB1-PNGF实现对新冠Spike蛋白N-糖基化位点的特异性编辑
