大肠杆菌在生物基化学品及酶蛋白生产中具有广泛的应用。乳糖操纵子系统是大肠杆菌中调控基因表达的重要组成部分,其中阻遏蛋白LacI通过结合操纵序列来抑制基因的转录。诱导剂IPTG通过与LacI结合,解除其抑制作用,从而调控基因表达。然而,IPTG对菌体生长有一定的抑制作用,且价格较昂贵,诱导不可逆(只能开不能关,不能震荡诱导)。
近日,中国科学院天津工业生物技术研究所赵国屏院士大师工作室张燕飞研究员团队研究开发了两种新型光控大肠杆菌基因表达系统,使用光照或黑暗代替IPTG,实现了安全、无毒,易操控地进行蛋白质生产与代谢通量调控。
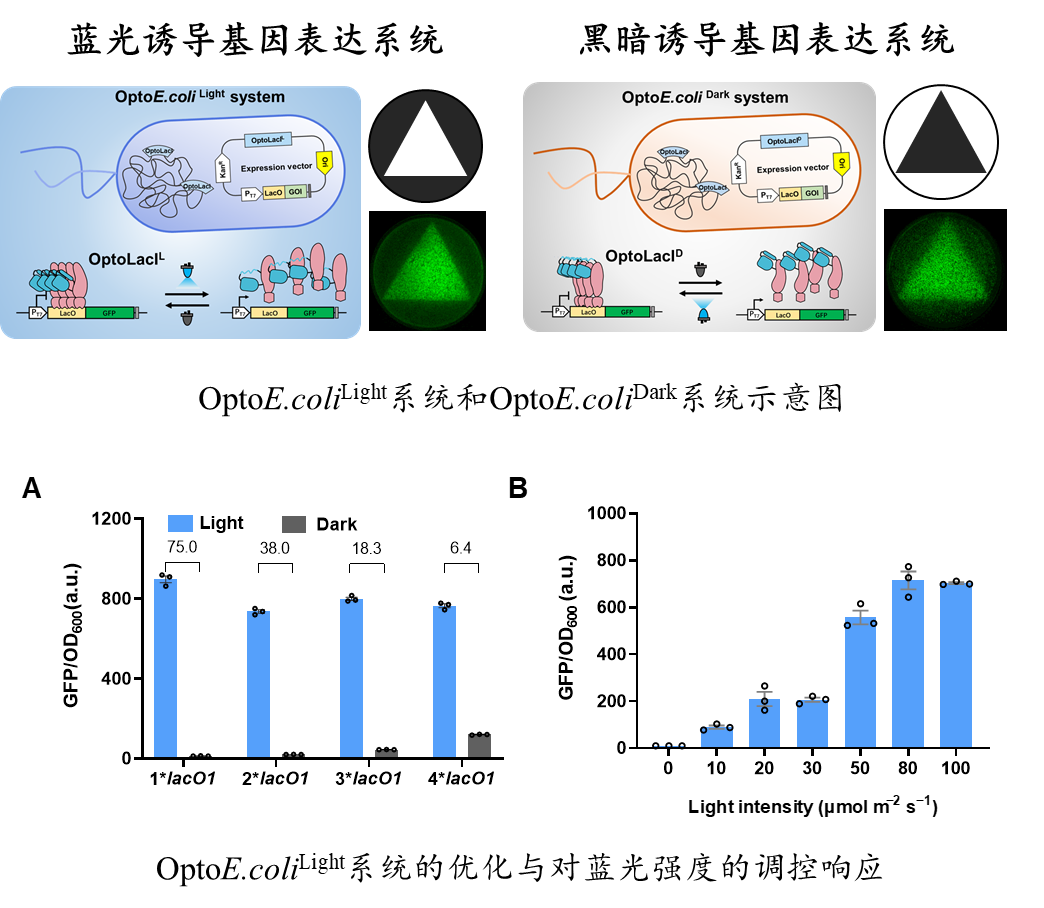
该团队以乳糖操纵阻遏蛋白LacI为研究对象,通过理性设计与光控蛋白质工程化改造(Optoprotein Engineering),引入蓝光响应元件AsLOV2结构域,构建了两种响应蓝光/黑暗的阻遏蛋白突变体OptoLacIL和OptoLacID。基于OptoLacI,又成功构建了两种分别响应蓝光或黑暗的光控大肠杆菌基因表达系统,即OptoE.coliLight系统和OptoE.coliDark系统。与IPTG诱导系统相比,这两个系统使用光照(或黑暗)作为诱导条件,实现对基因表达的诱导与控制。光/暗调控基因表达系统不使用化学诱导剂,可以分别实现光照诱导表达与黑暗诱导(发酵罐内)表达,其诱导效果与IPTG相当,且安全、无毒,易操控。
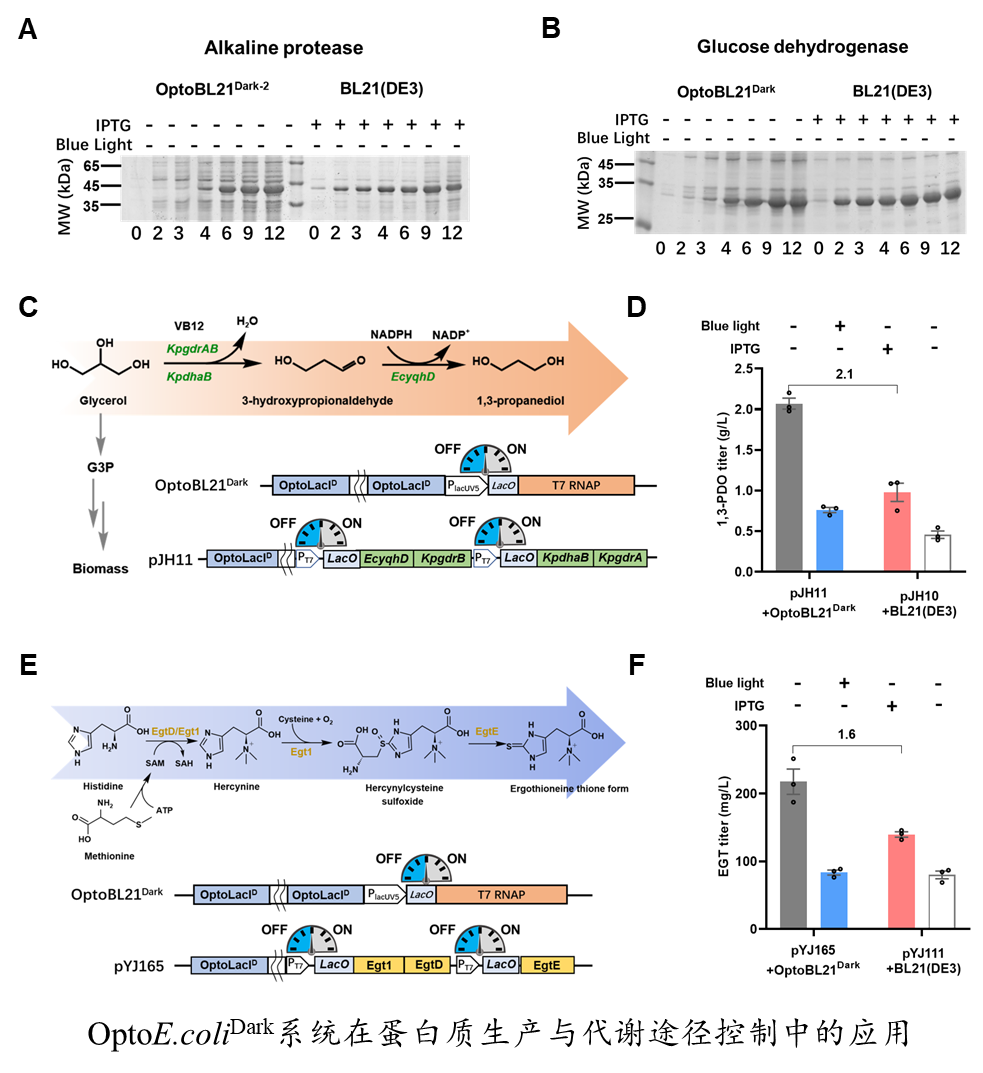
该团队将OptoE.coliDark系统(光照抑制表达,黑暗启动表达)应用于蛋白质生产和细胞工厂代谢途径的调控,已经实现葡萄糖脱氢酶、甲醛合酶、碱性蛋白酶、绿色荧光蛋白等多种酶蛋白的高效表达。在代谢通量控制方面,黑暗诱导生产1,3-丙二醇和麦角硫因的滴度分别超过IPTG诱导的110%和60%。该光/暗表达系统以光控阻遏蛋白OptoLacI为核心元件,组分简单,不仅在大肠杆菌中表现出色,而且具有良好的系统迁移性,可适用于除大肠杆菌以外的其他细菌和真核细胞,为更广泛的光/暗调控基因表达的应用提供了新的工具。
该工作得到国家重点研发计划、天津市合成生物技术创新能力提升行动以及合成生物学海河实验室重大攻关类项目的支持。论文发表于国际学术期刊Nucleic Acids Research。中国科学院天津工业生物技术研究所博士后刘美子、黄建峰和天津科技大学与天津工业生物所联合培养硕士李祖慧为论文的共同第一作者,张燕飞研究员和赵国屏院士为共同通讯作者。
论文链接
研究组长期招聘蛋白质工程、代谢工程与合成生物学方向的博士后,详情参见:天津工业生物技术研究所赵国屏院士大师工作室合成生物加工制造团队科研人员招聘启事
