生物催化由于其绿色、温和、高选择性等特点,正逐渐成为传统精细化学品制造的替代方法,但生物催化剂——酶,通常存在活性差、不稳定和难以回收利用等缺陷。将酶固定化后能够提高酶的催化活性和稳定性,并且可以重复使用,这使得酶固定化成为一种非常有效的策略,为生物催化剂的工业化应用起到了重要的助推作用。
近日,中国科学院天津工业生物技术研究所孙周通带领的生物催化研究中心团队与清华大学化学工程系王玉军团队合作,开发了一种可行的酶固定化策略,利用三氮唑类化合物和金属离子的协同桥接,诱导形成多孔的酶组装水凝胶,提高了酶催化活性和稳定性。水凝胶固定化后的醇脱氢酶对酮底物的催化还原效率是游离酶的6.3倍,在循环使用12个周期后仍具有较高的催化活性,且保持较高的立体选择性,证实了其稳定性和可重复使用性。进一步,通过冷冻电镜成功解析了水凝胶固定化酶近原子分辨率(2.1埃)的复合体结构,阐明了水凝胶形成的可能机制,揭示了三氮唑类化合物和金属离子在水凝胶形成过程中的重要作用,并结合计算模拟解析了固定化酶提高催化活性和稳定性的分子机制,该研究策略简单容易操作,可以为工业酶固定化应用提供理论和实践指导。
相关工作得到国家重点研发计划、国家自然科学基金项目等资助,研究成果发表在Nature Communications期刊,清华大学博士研究生陈强为论文第一作者、天津工业生物所曲戈副研究员和李旭博士为共同作者,孙周通研究员和王玉军教授为共同通讯作者。
文章链接
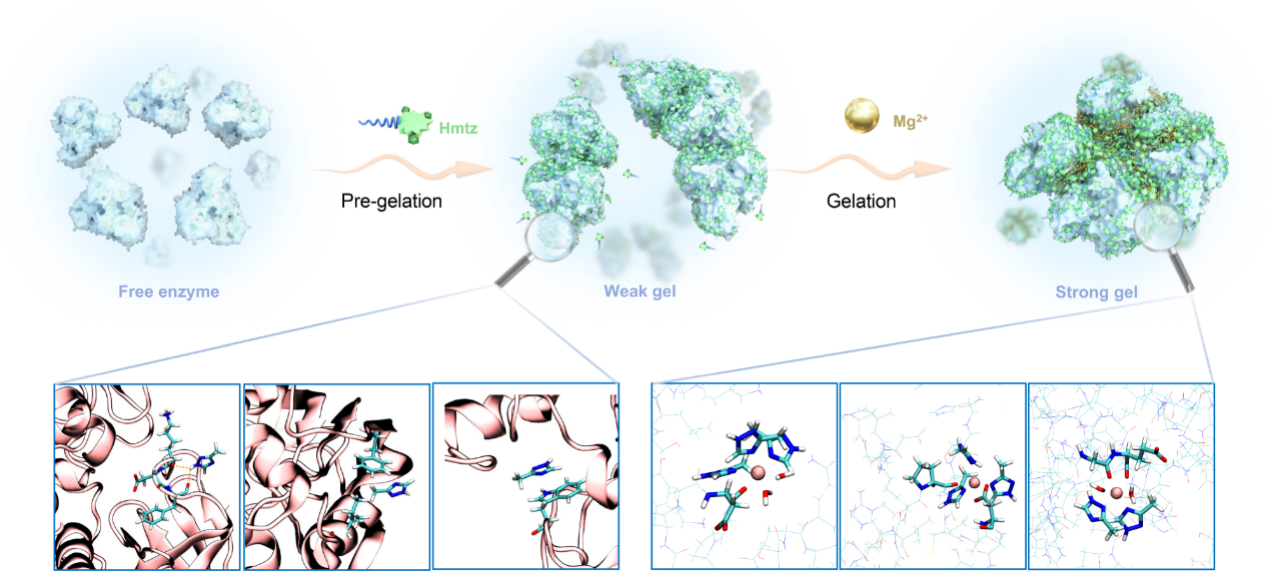
水凝胶固定化酶形成原理示意图
