基因组的拷贝数问题是生命科学领域的基础问题体系之一,多拷贝现象可能涉及细胞内的多个生物过程,目前涉及基因组拷贝数的一些问题尚得不到解答。理论分析可知,与单倍体相比,多倍体最突出的特征是具有高效的双链DNA断裂修复系统,极低的自发突变率,以及在极端环境下生存的能力。除此之外,多倍体还具有全局调控基因表达、调节基因剂量和控制细胞体积等特点。然而,由于缺乏科学性实验材料,这些生物进化学理论尚没有得到实验验证,也不清楚细菌多倍体是否比单倍体具有进化优势。目前,只有通过经典的培养方法才能获得相应的单倍体和多倍体植物和酵母,有关多倍体的机制和功能的科学研究主要局限于少数真核生物。如何利用分子遗传学技术有针对性地设计和创造出简单而理想的人工单倍体和多倍体模式细菌是进行多倍体研究亟需解决的瓶颈问题。
中国科学院天津工业生物技术研究所毕昌昊研究员带领的合成生物技术研究团队、张学礼研究员带领的微生物代谢工程团队与天津师范大学李菊教授和大连工业大学张春枝教授带领的团队合作,开发了一种基于CRISPR的基因组加倍工程技术,并构建了人造二倍体大肠杆菌。
研究团队首先将被氯霉素抗性基因和一分为二的青霉素抗性基因通过同源重组整合至野生型大肠杆菌基因组上,根据大肠杆菌基因组θ型复制特点,当一个菌体细胞内含有两个或多个编辑盒时,引导CRISPR-Cas9切割氯霉素抗性基因两端,被一分为二的青霉素基因由此在大肠杆菌体内自发重组为完整的青霉素抗性基因(该过程对条件要求较高,Cas9系统的诱导强度、青霉素补充的时机、接种的比例都会直接影响后续结果)。随后,团队使用稀释涂板和流式细胞技术对所得培养物中的单菌进行分离,再使用多种方法对获得的人造二倍体大肠杆菌的基因组构型进行鉴定分析。结果显示,菌落PCR、qPCR、FISH及基因组de novo 均为基因组二倍体构型。对比研究野生型和人造二倍体大肠杆菌,发现菌体形态和辐射耐受性能等方面都产生了明显差异。扫描电镜显示,人造二倍体大肠杆菌长度明显长于野生型大肠杆菌,多数为4~5μm;更有趣的是,人造二倍体大肠杆菌紫外线辐射耐受性较野生型提高了近40倍。这将为人造多倍体大肠菌在细胞工厂中的应用提供可能。考虑到基因组加倍工程可能扰乱染色体分离及细胞分裂机制,细胞生理代谢网络也可能需要重建。经100代培养,在无抗生素的培养基中,人造二倍体大肠杆菌的基因组构型的稳定性较差,而在含有双抗的培养基中,人造二倍体大肠杆菌的基因组构型则非常稳定。生长曲线结果显示,人造二倍体大肠杆菌较野生型生长明显较慢,倍增时间增加了约一倍。这些特征和区别在全转录组测序中得到了佐证。
该项技术机制原理通用性较高,有望应用于其它原核生物的合成生物学研究和应用中。二倍体大肠杆菌是具有巨大研究和应用潜力的新型人工物种,是合成生物学的重要成果,为工业生产带来了新的可能。
该研究工作得到国家自然科学基金、国家重点研发计划和天津市合成生物技术创新能力提升行动的资助,相关研究结果发表于Advanced Science期刊。天津工业生物所助理研究员王鹏举、副研究员赵东东和天津师范大学教授李菊是该论文第一作者,毕昌昊研究员和张学礼研究员为该论文共同通讯作者。
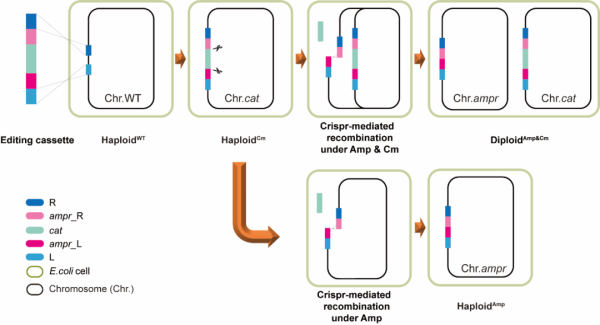
基于CRISPR的染色体加倍技术
