氢转移在生化反应中起着至关重要的作用。前期科研工作者已研究并报导了多种形式的酶介导氢转移反应,并揭示了氢负离子转移(Hydride transfer,HT)与氢质子转移(Proton transfer,PT)过程耦合的重要性。实验结果表明参与HT或PT路径的残基突变通常会导致活性降低或失活。然而通过缩短氢转移路径能否提升酶催化效率等关键科学问题尚缺乏深入研究。
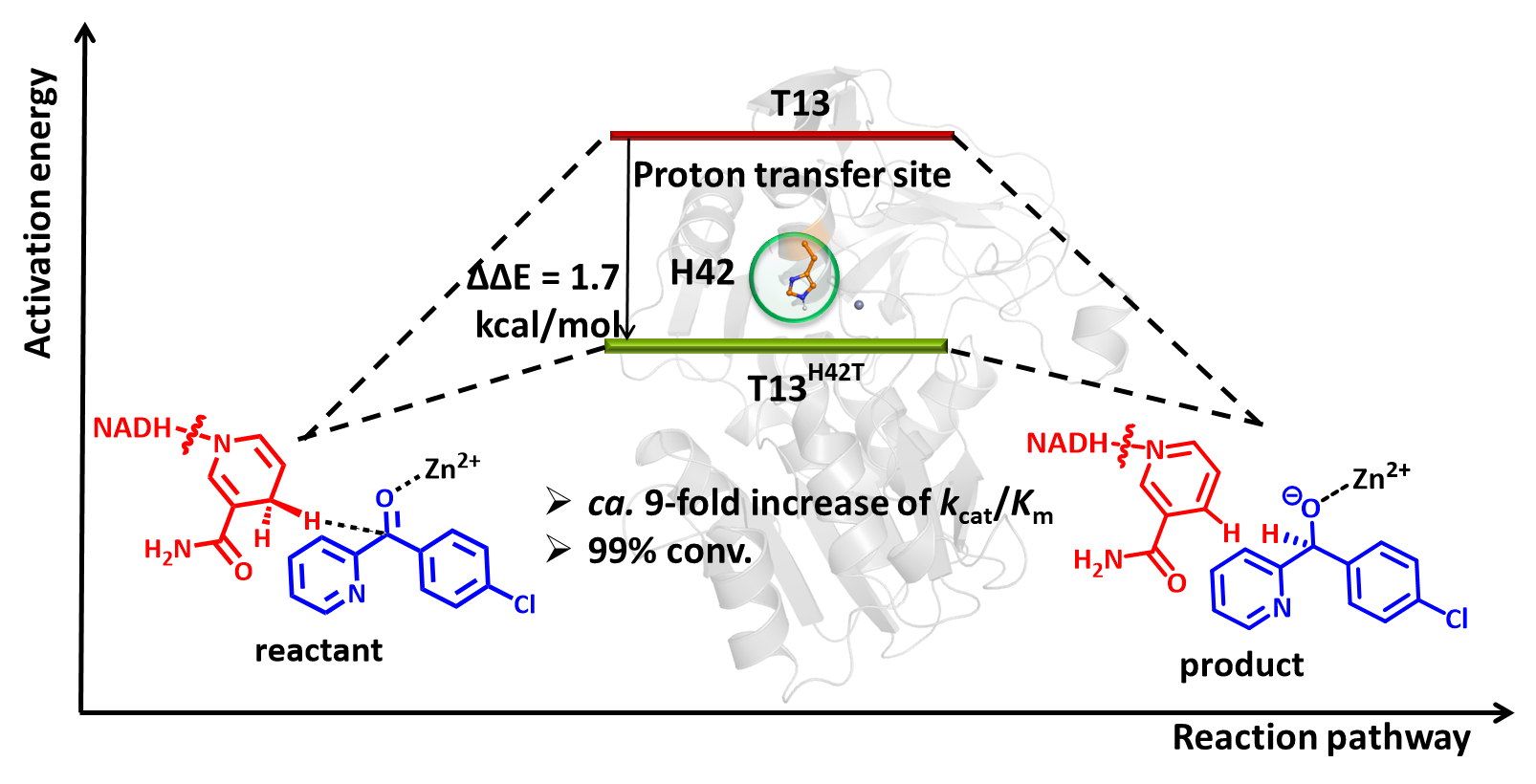
中国科学院天津工业生物技术研究所/国家合成生物技术创新中心Reetz大师工作室孙周通研究员带领团队以嗜热厌氧杆菌(Thermoanaerobacter brockii)来源的中链醇脱氢酶TbSADH催化底物CPMK为模式反应,探索不同PT路径对酶活性的影响。通过系统发育进化分析发现,该酶PT步骤中关键残基H42位点的保守性较差。此外,基于TbSADH晶体结构对H42位点进行了理性设计并进行了实验验证,筛选出了优势突变体T13H42T。相较初始模板,在立体选择性(>99% (S)-ee)及热稳定性(Tm > 76 oC)均未损失的前提下,该突变体催化活力(kcat/Km)提高约9倍。随后,使用分子动力学模拟(Mmolecular Dynamics,MD)和量子化学(Quantum Mechanical,QM)等计算手段,深度解析了突变体T13H42T的催化机制,并探究了其活力提高的可能原因。该研究丰富了中链醇脱氢酶的氢转移机制,也为进一步指导该类酶的理性设计奠定了理论基础。
该研究获得了国家自然科学基金、天津自然科学基金、国家重点研发计划、天津市合成生物技术创新能力提升行动等项目资助,论文发表于Molecular Catalysis期刊。天津工业生物所博士研究生蒋迎迎、博士后李旭为论文共同第一作者,曲戈副研究员和孙周通研究员为论文共同通讯作者。
文章链接
醇脱氢酶不对称催化还原CPMK化合物
