酿酒酵母作为合成生物学最重要的底盘细胞之一,广泛用于开发传统酿造食品、大宗化学品和高附加值产品。基因组编辑技术爆炸式发展,为加快酿酒酵母细胞工厂的构建与优化提供强有力的使能技术,但当前研究主要集中于编辑工具本身的优化和同源重组介导的精准编辑。利用基因组编辑技术进行NHEJ介导的致基因组多样性突变和可遗传转录调控的相关研究鲜有报道,这主要受限于酿酒酵母NHEJ修复引入突变能力较差。
近日,中国科学院天津工业生物技术研究所王钦宏研究员带领的进化与代谢工程研究团队基于酿酒酵母内源的双链DNA断裂(DNA double-strand break, DSB)修复途径设计改造和CRISPR基因组编辑,建立了不依赖模板的高效致突变基因组技术(mutagenic Genome Editing, mGE),并实现靶向基因的可遗传多样性调控表达。研究人员通过评价和比较DNA修复途径中9个关键基因的敲除、过表达或氨基酸突变等16个改造对4种常用编辑工具(CRISPR/Cas9、CRISPR/Cpf1、TALENs、CRISPR/Cas9-N863A)在没有外源DNA模板的情况下引入随机突变能力的影响,发现调整DNA修复蛋白,特别是Mre11、Sae2 和Exo1等DSB末端切除蛋白显著增强不同基因组编辑工具引入突变的效率和多样性。在此基础上,研究人员利用MRE11-H125N(MRE11核酸酶活性失活的等位基因)和CRISPR/Cpf1组合形成致基因组多样性编辑策略,并通过调节FPS1和GPD1的表达有效提高乙醇生产能力。该研究结果将扩大基因组编辑在基因表达多样化和增强基因组进化中的应用。
该研究获得天津市合成生物技术创新能力提升行动项目、中国科学院科研装备研制项目、国家自然科学基金等基金的支持,相关研究成果发表在Microbiology Spectrum,天津工业生物所博士毕业生王震和副研究员蔺玉萍为论文共同第一作者,王钦宏为通讯作者。
文章链接
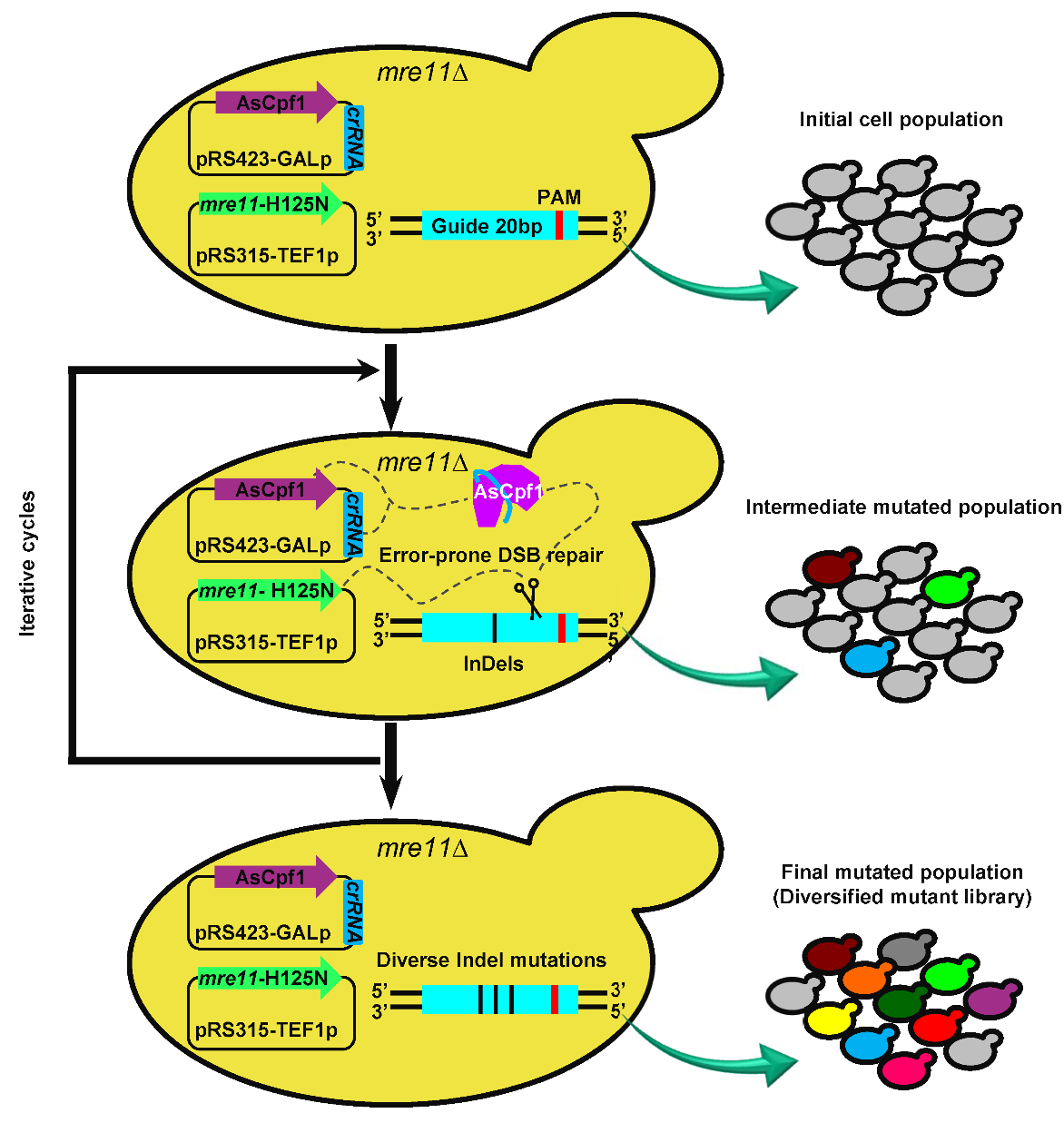
调控酿酒酵母DSB修复途径实现基因组多样性编辑
