生物-电极在生物电池、生物传感和生物电合成等方面都有重要应用。在酶-电极构建过程中,为实现高效生物电子传递,需要设计一定的结合驱动力、合理的酶-电极交互方式和稳定的界面微环境。根据Marcus电子传递理论,传递距离和电势差是制约传递速率的重要因素。由于酶分子复杂的表面理化性质和结构组成,研究酶-电极界面上酶与电极的结合方式和互作机制,使酶以特定空间取向固定于电极,对实现高效生物电子传递和提高酶-电极性能具有重要意义。
近日,中国科学院天津工业生物技术研究所体外合成生物学中心朱之光研究员带领的团队以一种结构复杂的四亚基氢酶(PfSHI)为对象,通过设计不同的PfSHI-电极界面,结合直接电化学法对界面微环境的解析,验证了酶与电极的交互结构域为γ亚基,其结合辅因子 FAD 和[2Fe-2S]2+/1+均能与电极进行直接电子传递。通过分析界面表面电荷、非转化信号、电子转移数和酶构象之间的关系,预测了该氢酶在不同带电电极表面上的微观构象,建立了多个酶-电极界面模型。另外,该研究还通过测试PfSHI在不同pH值下直接电催化和间接电催化电流的大小及比率,对各模型相关动力学参数进行拟合和计算,得到了不同酶-电极界面隧穿距离和电子传递效率的大小分布,并设计出最优的一组酶-电极界面。基于以上结论及石英晶体微天平测试,预测了PfSHI在电极表面吸附动力学过程,阐明了PfSHI在功能化电极上的吸附机理,为构建高性能生物电催化界面提供了理论基础和实验模型。
该研究获得了国家重点研发计划、国家自然科学基金和天津市合成生物技术创新能力提升行动等项目资助,论文近期发表于ACS Catalysis。天津工业生物所博士生王园明为论文第一作者,朱之光为论文通讯作者。
文章链接
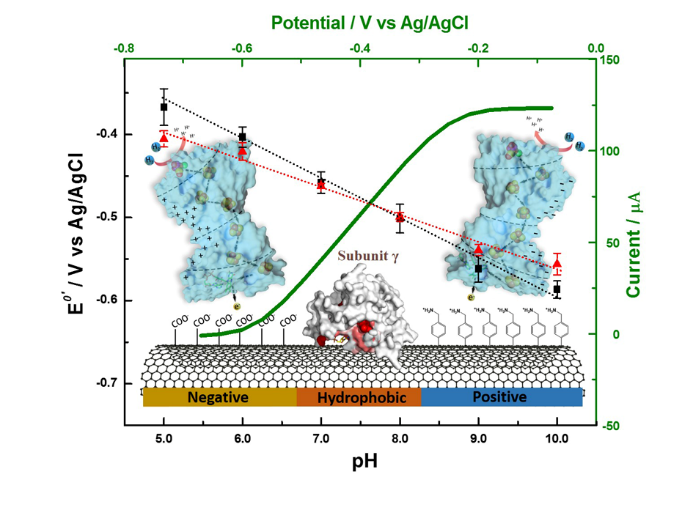
PfSHI与不同电极结合方式和互作机制示意图
