手性β-氨基酸不仅是天然化合物中的重要组成部分,而且是合成许多药物分子的重要砌块。从原子经济性和对环境的影响考量,氨基酸脱氢酶(AADHs)作为生物催化剂在手性氨基酸的不对称合成中具有巨大潜力。然而,与被广泛研究的α-AADHs相比,目前β-AADH家族中的已知成员只有l-赤式-3,5-二氨基己酸脱氢酶(3,5-DAHDH),且没有相关晶体结构和催化机理方面的研究报道,对其合成手性β-氨基酸的应用开发也非常有限。
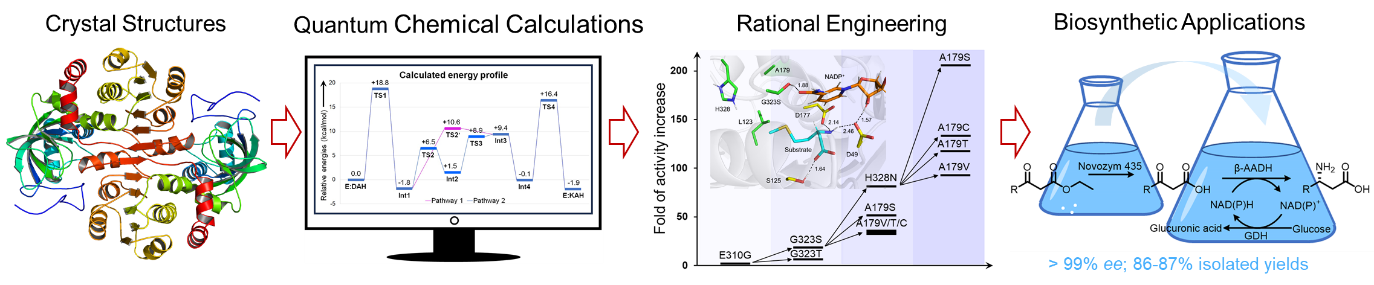
中国科学院天津工业生物所朱敦明研究员、吴洽庆研究员带领的团队与盛翔研究员及中国科学院深圳先进院周佳海研究员等团队合作,开展了来源于Candidatus Cloacamonas acidaminovorans的3,5-DAHDH(3,5-DAHDHcca)的晶体结构、催化机理及改造应用研究。结果表明,3,5-DAHDHcca与α-AADHs晶体结构相比有很大的不同。3,5-DAHDHcca的完整催化功能单元是同源二聚体,且活性中心恰好位于两个亚基聚合的区域;而α-AADHs单亚基即可完成催化。通过量子化学计算及定点突变研究,一方面对该酶的底物结合模式和催化机制有了更加深入的了解,确证了关键的底物识别和催化位点;另一方面,也为后期蛋白理性设计提供了非常有力的指导。通过重新构建NADPH酰胺基团与附近残基的氢键相互作用,并重塑底物口袋以更好地容纳底物分子,在不牺牲对映选择性的前提下极大地提高了酶催化活性,获得了对多种脂肪族β-氨基酸活性提高110-800倍的优异突变体。并且,利用这些优异突变体还原胺化相应β-酮酸(底物浓度达154mM),实现了(R)-β-高甲硫氨酸和(S)-3-氨基己酸的高效不对称合成,其ee>99%,分离产率为86%-87%。
本研究不仅揭示了3,5-DAHDH的底物特异性分子基础和催化反应机理,而且为进一步设计β-AADHs不对称合成目标β-氨基酸奠定了坚实的基础,从而开辟了一条绿色合成b-氨基酸的新途径。
该研究工作得到国家自然科学基金、天津市合成生物技术创新能力提升行动、国家重点研究开发项目的支持。相关研究成果已在Angewandte Chemie International Edition 上发表。天津工业生物所博士研究生刘娜为论文的第一作者。
文章链接
β-氨基酸脱氢酶:晶体结构、催化机理指导的理性设计及合成应用
