近年来,CRISPR/Cas9的新型碱基编辑技术迅速发展。David Liu实验室通过将催化失活的Cas9蛋白与胞嘧啶脱氨酶融合在一起,利用具有序列特异性的gRNA引导复合物靶向目标基因,实现了由C到T的单碱基转换;随后该实验室又建立了腺嘌呤碱基编辑器(ABE),实现了由A到G的精确转换。但是可能由于在大肠杆菌中ABE缺少对未编辑细胞的选择性压力导致的编辑效率较低,目前还没有关于ABE在大肠杆菌中成功编辑的报道。
中科院天津工业生物技术研究所张学礼研究员带领的微生物代谢工程团队和毕昌昊研究员带领的合成生物技术研究团队,通过构建两种不同的ABE碱基编辑系统,实现了ABE在大肠杆菌中的编辑。同时该研究团队又建立了一种双重检查碱基编辑系统(DBE,Double-check base editing),该系统利用活性Cas9可以导致>98%细胞双链断裂,从而导致细胞死亡的特点,通过在ABE系统的基础上引入活性Cas9,用阿拉伯糖诱导活性Cas9杀死未发生编辑的细胞,施加对未编辑细胞的选择性压力,从而提高ABE在大肠杆菌中的编辑效率。该研究团队选取大肠杆菌10个不同的gRNA位点对DBE系统进行验证,碱基编辑的效率均有相应的提高,最高编辑效率可达99%。随后又在真核细胞H293T中,选取5个不同位点进行相关实验,结果显示,由于细胞中的非同源末端连接修复机制较强,细胞基因组N20后碱基序列发生改变,由此得知该DBE系统不适用于真核细胞。该研究实现了大肠杆菌中的ABE编辑,并且构建了DBE系统,显著提高了ABE在大肠杆菌中的编辑效率,为原核细胞的基因编辑提供了新思路。
该研究获得国家自然基金、科技部“863”计划和天津市重点专项的支持,相关成果发表在ACS Synthetic Biology。中科院天津工业生物所与天津科技大学联合培养硕士研究生信秀青、天津师范大学教授李菊为论文共同第一作者,中科院天津工业生物所毕昌昊研究员、张学礼研究员为论文的共同通讯作者。
文章链接
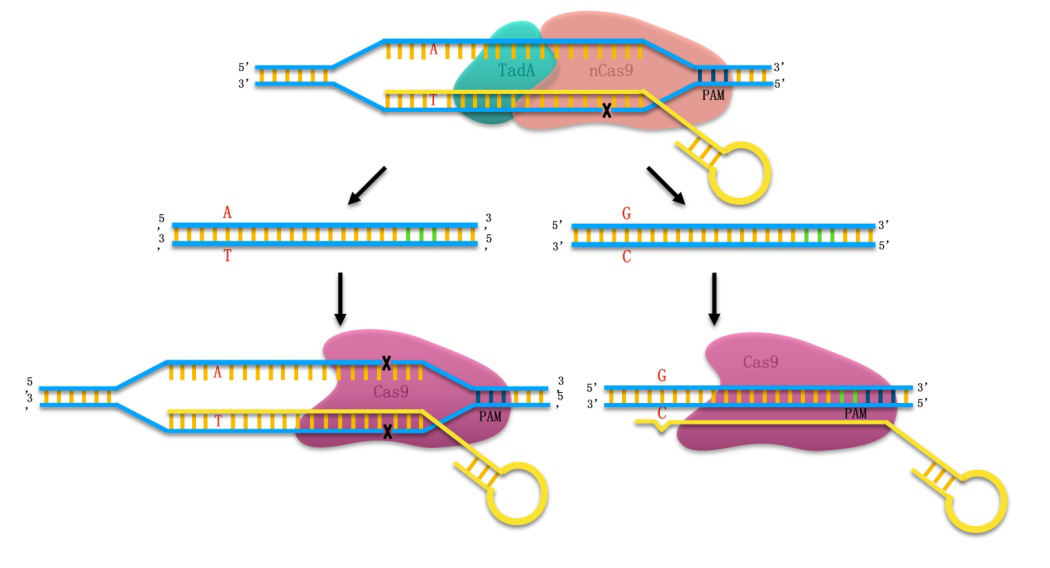
Double-check碱基编辑系统的机制
