B-factor(又称Debye-Waller factor或temperature factor)是用来描述X-射线衍射蛋白晶体结构时由于原子热运动造成的射线衰减或散射现象。由于B-factor所体现的数值(B值)可用于识别蛋白结构中的原子、氨基酸侧链及loop区域的运动性及柔性,因而广泛应用于研究蛋白动力学、筛选生物活性小分子以及蛋白质工程领域,具有极为重要的科学研究意义。然而目前缺少对B-factor研究工作全面而深入的分析及评述。
近日,中科院天津工业生物技术研究所孙周通研究员带领的酶分子工程与工业生物催化研究团队与Manfred T. Reetz教授及上海交大冯雁教授联合在国际顶级综述类期刊Chemical Reviews发表综述文章“Utility of B-Factors in Protein Science: Interpreting Rigidity, Flexibility, and Internal Motion and Engineering Thermostability”。从B-factor发展历史、早期应用(蛋白柔性区域识别及蛋白分子内运动)以及当前开发研究等多个角度,系统总结了B-factor的应用历史进程及其在蛋白质工程领域扮演的重要角色,特别指出基于B-factor进行酶分子设计是提高蛋白质稳定性的有效策略,并展望了未来借助计算机技术,可进一步提高B-factor研究的准确性及扩大其应用领域,对构建具有高度稳定性的进化酶、深度揭示酶热力学与催化效率、底物选择性等复杂调控关系具有促进作用。早期人们仅利用B值评估蛋白晶体结构中氨基酸Cα原子的性质进而衡量蛋白骨架的运动性;接着人们意识到B值还可反映蛋白柔性,即蛋白结构中B值越高的区域其运动性越好,反之,B值越低意味着刚性越强;通过统计发现,蛋白酶催化活性中心通常位于低B值区域,该特征被用来预测酶活性中心位置;后来发现蛋白质热稳定性与其刚性密切相关,自此B-factor被广泛应用于蛋白质工程。文章同时综述了上百个基于B值进行蛋白质改造设计的实例,包括改造其立体选择性、热稳定性和对有机溶剂的抗性及催化活性等参数。
B-factor可通过晶体解析技术(X-ray、NMR、cryo-EM)获得。然而通过实验获得的B值也存在缺陷,如蛋白结构解析分辨率太低(如3~5埃)时,实际测量的B值就不准确。此外还受到晶体堆积、结构优化过程等因素干扰,因此在比较B值大小时,需要对其进行标准化处理。一系列基于实验B值的算法和软件(RONN、Maranas、SCHEMA、FireProt、CAN、RosettaDesign、FoldX、FRESCO及B-FIT等)被开发,用于识别并改造蛋白柔性区域以提高其热稳定性。其中,B-FIT被认为是一种相对普适的分子进化策略,通过分子设计寻求结构柔性与刚性间平衡,为突破蛋白质结构多样性、分子进化途径复杂性等因素的限制,重塑和提升蛋白质分子稳定性提供指导和启示。此外,人们借助计算技术(同源建模、分子动力学模拟等),开发了PROFbval、MoRFpred及ResQ等计算程序,即使在蛋白晶体结构缺失的情况下,依靠蛋白序列及同源相似性等信息依旧可以预测蛋白各氨基酸残基的B值。
该综述得到国家自然科学基金等科技项目的资助,并已在线发表于国际顶级化学学术期刊Chemical Reviews。该期刊是国际化学领域影响力最高的学术期刊之一,2018年公布的影响因子为52.613。天津工业生物所孙周通研究员为论文第一作者兼通讯作者,上海交通大学冯雁教授及德国马普煤炭所/天津工业生物所Manfred T. Reetz教授为共同通讯作者。
文章链接
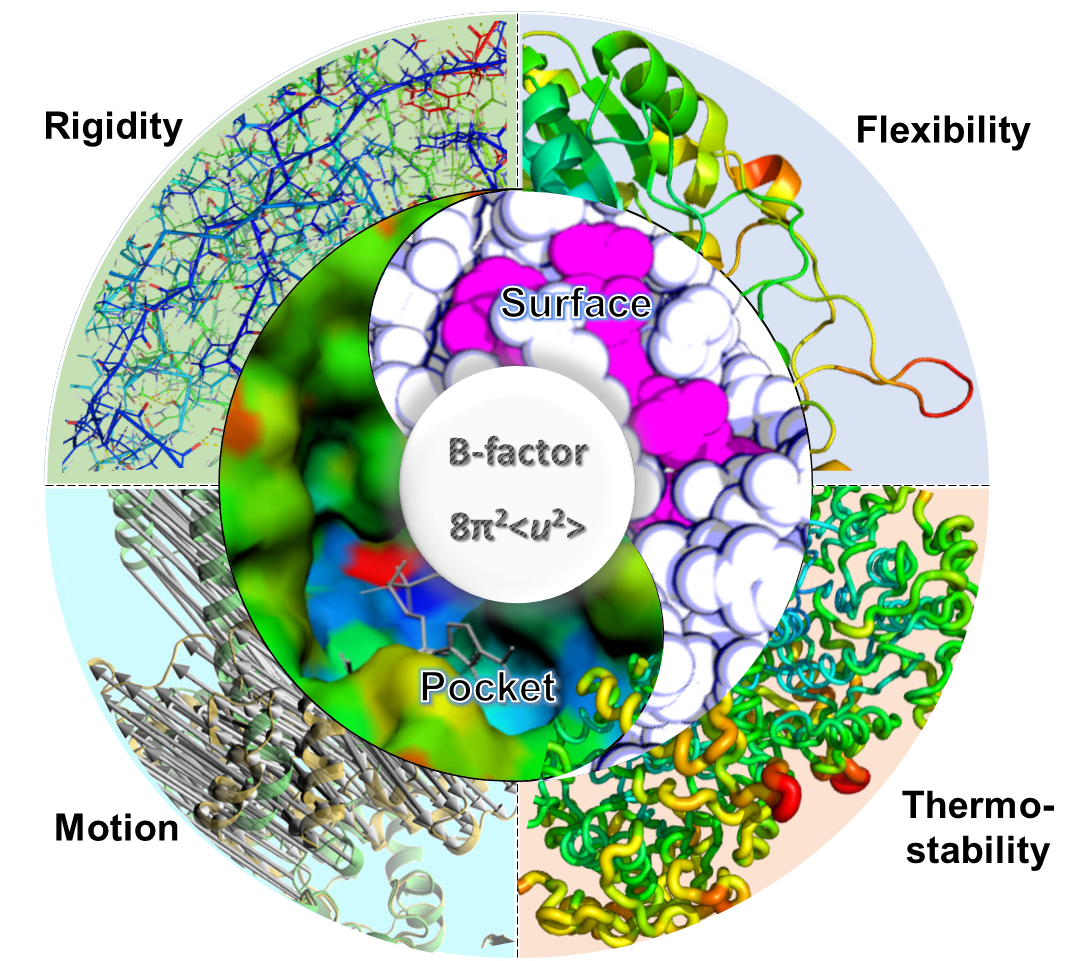
B-factor应用领域
