植酸酶是重要的饲料添加剂,来自大肠杆菌的植酸酶(EcAppA)为目前所知活性最高的植酸酶之一,具有重要的商业应用价值,但是EcAppA的耐热性较差,需要进一步增强以避免在饲料制程中经高温处理而失去酶活。
中科院天津工业生物技术研究所的郭瑞庭研究员带领的研究组和东莞泛亚太生技公司及台湾基酵生技公司合作,以植酸酶晶体结构为基础,对大肠杆菌植酸酶进行理性设计以增加酶活及耐热性。最近报导的两个柠檬酸细菌 (Citrobacter): C. amalonaticus以及C. braakii植酸酶具有高活性以及高耐热性,其氨基酸序列与EcAppA有高度相似性 (60及57 %)。我们将EcAppA与两个Citrobacter植酸酶进行序列分析,并对照EcAppA及其底物复合物的晶体结构,比对出活性区附近Citrobacter植酸酶特有的氨基酸,然后将EcAppA上相对的位点进行突变改造,结果发现V89T突变体的活性增加了17.5%。从蛋白质结构模型上分析发现,T89这个位点可能与邻近的氨基酸形成氢键,进而稳定所在的loop区域结构而增加酶活。此外,C. braakii植酸酶 (CbAppA) 和EcAppA分别具有五个和三个糖基化位点,针对这些糖基化位点进行分析,发现有一个在底物结合域附近的糖基化位点是两个酶共有的 (NVS204-206),而其他的则不相同。NVS204-206 可能影响底物结合以及产物离去,所以我们进行突变将之去除,发现酶活因此提高了9.6%。另一方面,我们把CbAppA特有的四个糖基化位点分别加到EcAppA上,其中三个单一位点的突变体在80oC的耐热性从1.8%提升到5.6-9.5%,而同时带有三个糖基化位点的突变体的耐热性更大幅增加到27%,这些结果显示,我们成功透过理性设计的手段将EcAppA改造的更为耐热,活性更高。
研究成果已被Journal of Biotechnology接收。该项目获得863项目和973项目以及天津专项的支持。
文章链接
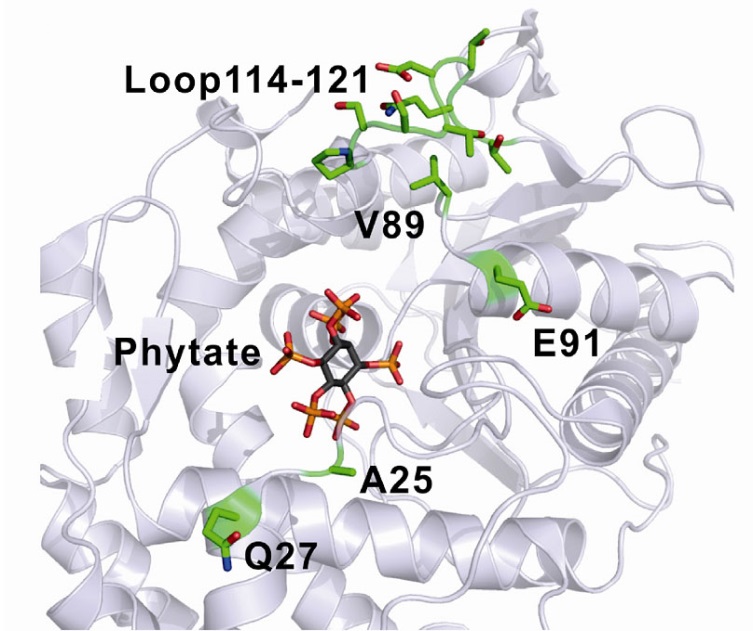
大肠杆菌植酸酶的晶体结构及改造位点
