天津工业生物技术研究所等在甲醛缩合酶结构设计方面取得新进展
字号:【大】 【中】 【小】
近年来,人工设计的甲醛缩合酶formolase因其催化单一底物甲醛的羟醛缩合反应而备受关注。凭借反应热力学的可行性、原子经济性等诸多优势,formolase已广泛用于多种人工C1化合物转化途径。在与其他酶偶联的多酶系统或细胞工厂中,由于甲醛对酶具有毒性,通常需采用低浓度甲醛进行反应。因此,开发能够在低浓度甲醛条件下表现出更高催化活性的formolase变体成为研究的重点。
中国科学院天津工业生物技术研究所朱蕾蕾研究员带领的蛋白质定向进化研究团队,发现由α17-螺旋和α21-螺旋组成的拉链结构通过调控底物通道的大小和形状来调节甲醛缩合酶formolaseBFD的活性。其中,作为底物通道壁一部分的α21-螺旋,充当通道调控螺旋的角色,在拉链结构的开闭状态转换中发挥了重要作用。因此,针对该调控螺旋进行工程化改造,增强了底物甲醛在活性口袋的富集,成功获得了在低浓度甲醛条件下活性显著提高的formolaseBFD变体。
研究首先以formolaseBFD-M3为模板通过定向进化获得了低甲醛浓度下高活性突变体K1(W463R/S26F/H281Y)。基于图1所示的结构分析,发现三个突变位点均与一个参与底物/产物通道壁构成的α21-螺旋相关。其中,W463R位于α21-螺旋上,并与二聚体中另一单体上的S26F和同单体上的H281Y相邻。考虑到α21-螺旋的C端与一个长而灵活的环连接,可能会赋予α21-螺旋结构运动的能力。我们大胆假设α21-螺旋可以通过运动调节通道的大小与形状,进而调控底物进入或产物的释放。为验证假设,我们采用DynDom预测(图2a)和加速分子动力学模拟(图2b)的手段确定了α21-螺旋存在结构运动的现象。进一步,选择α21-螺旋上的通道朝向的三氨基酸位点M460、W463和L467(图3),以K1为模板进行了多位点饱和突变。通过筛选发现多个突变体在20 mM、300 mM甲醛下的活性高于K1。如图4所示,突变体K1到K7在5至180 mM甲醛浓度范围内的活性显著高于formolaseBFD-M3,尤其是在较低浓度下。具体而言,变体K1-K7在160 mM甲醛下的活性提高了7至14倍,在50 mM甲醛下的活性则显著提高了28至57倍。最佳变体K6在20 mM甲醛下的活性比formolaseBFD-M3提高了27.3倍,在160 mM甲醛下提高了13.9倍,在40 mM甲醛下达到最大倍数提升,86.5倍。通过晶体结构解析与分子动力学模拟等手段,确定了最佳突变体K6能够稳定底物通道的底部区域,避免了活性中心的暴露,并通过α21-螺旋构象变化使打开了底物通道的入口,从而使甲醛更容易进入通道并到达活性中心(图5)。
该研究得到国家重点研发计划、中国科学院战略性先导科技专项、国家自然科学基金等项目的支持,相关研究成果于近日发表在ACS Catalysis期刊上。南京中医药大学客座博士生谭子瑊和天津工业生物技术研究所科研助理唐梓静为该论文共同第一作者,朱蕾蕾研究员与南京中医药大学刘海峰教授为该论文共同通讯作者。
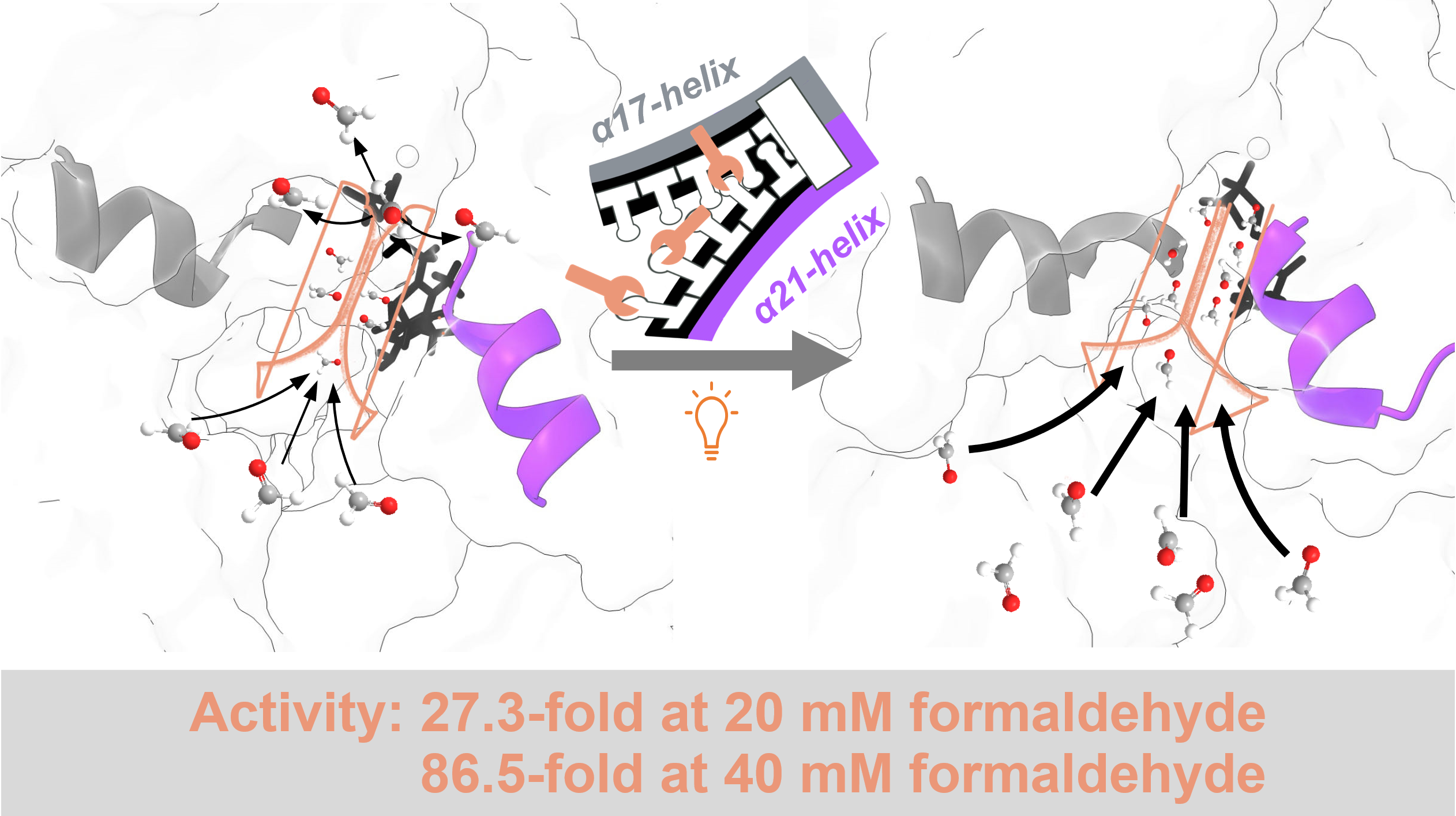
通道调控螺旋拉链结构设计提升FormolaseBFD低浓度甲醛转化性能
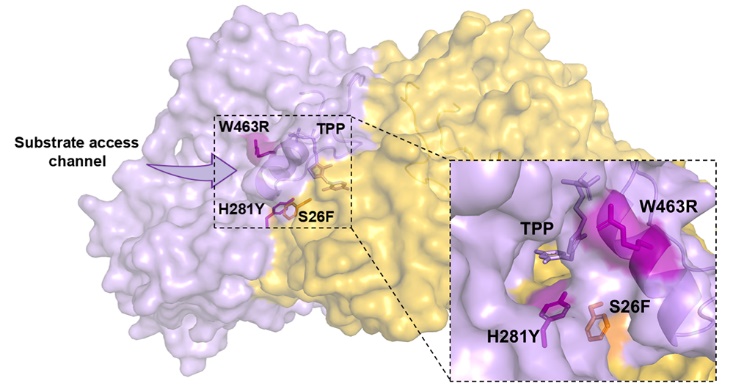
图1 α21-螺旋与K1的突变位点的位置展示。图示的W463R、H281Y及α21-螺旋在一个单体上,S26F在另一个单体上
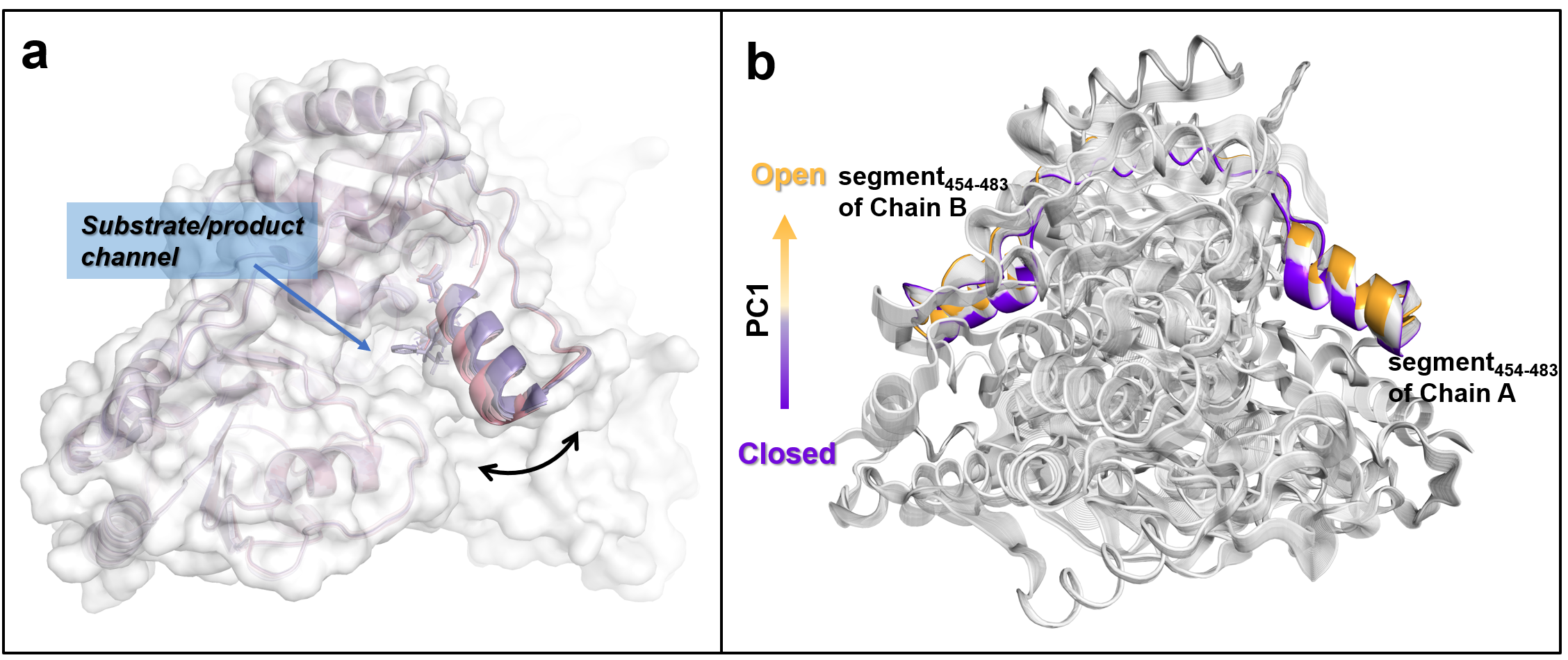
图2 α21-螺旋的结构运动分析。a)DynDom基于11个BFD结构预测α21-螺旋的潜在运动。d)加速分子动力学模拟中formolaseBFD-M3沿第一主成分(PC1)的结构运动
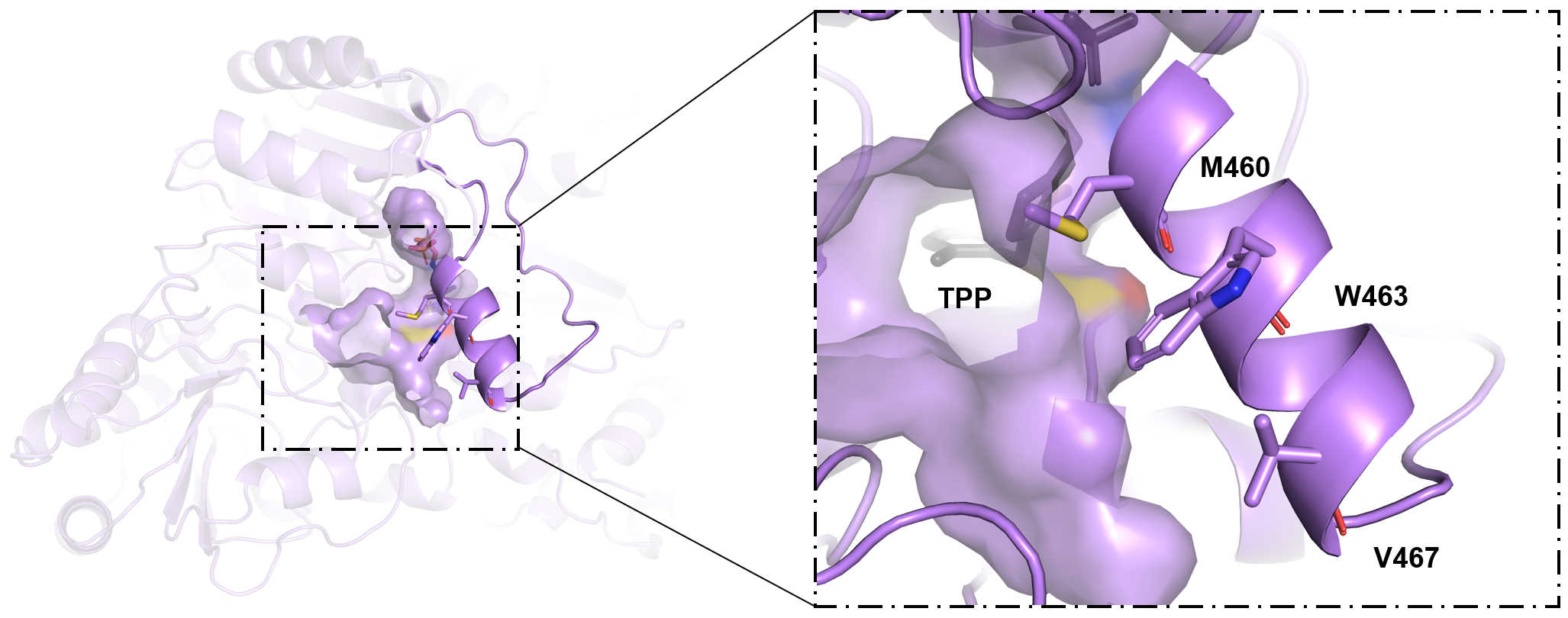
图3 通道朝向的三个氨基酸位点M460、W463和V467
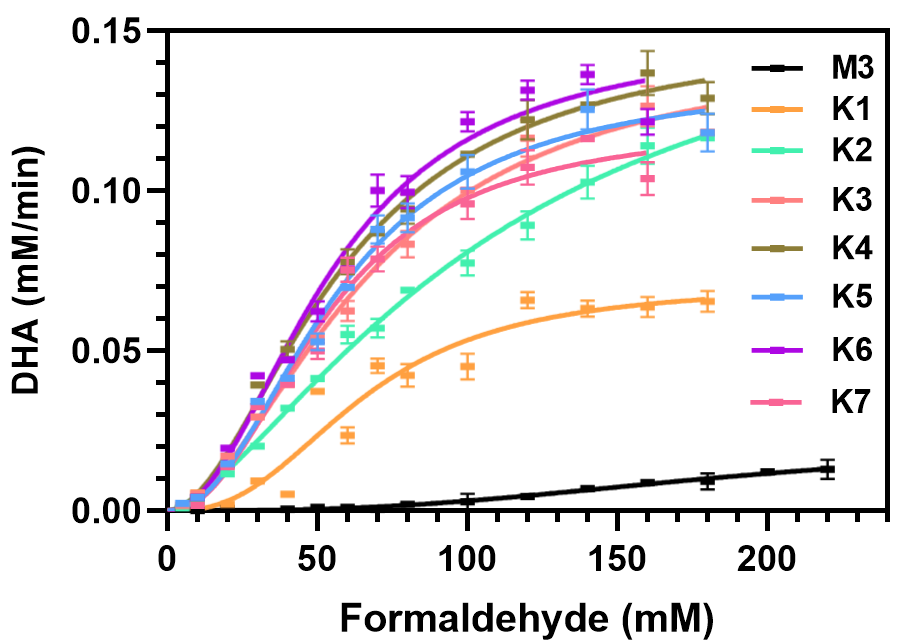
图4 FormolaseBFD-M3及其突变体的反应动力学测定
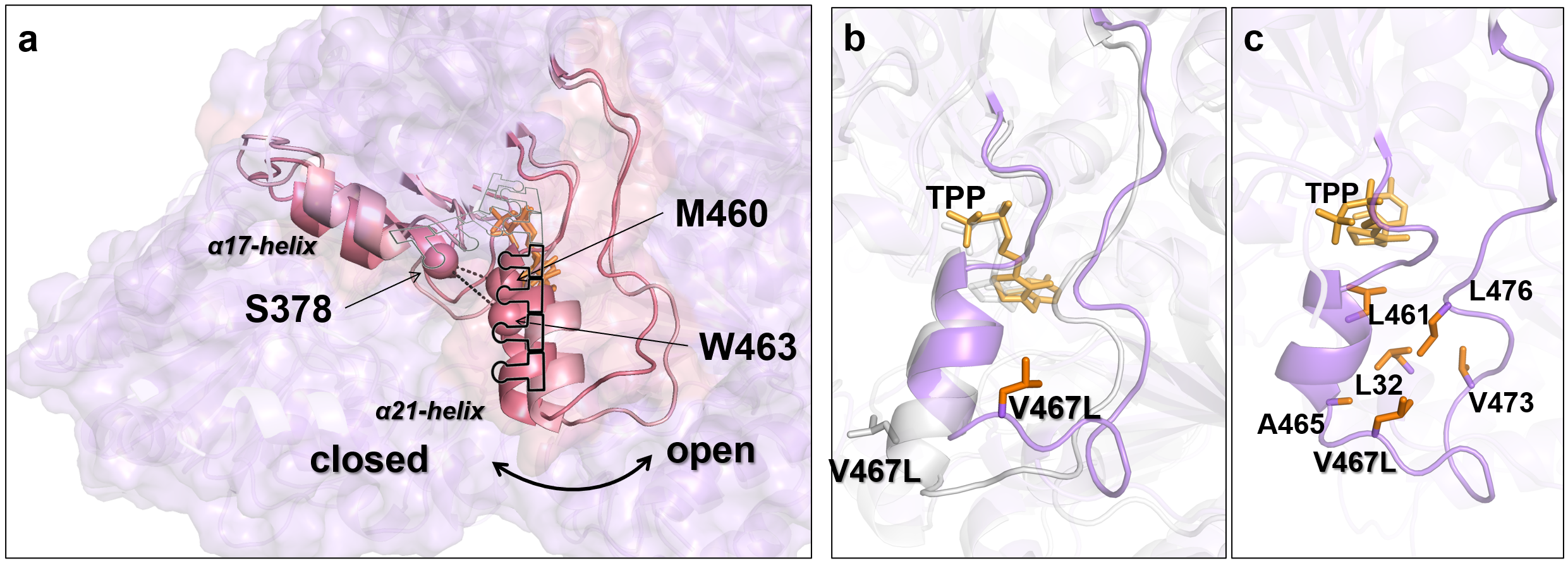
图5 FormolaseBFD-M3和变体K6(M3-S26F/H281Y/W463Q/V467L)中α21-螺旋的结构运动。a)FormolaseBFD-M3中W463所在的α21-螺旋存在关闭拉链结构的主要构象(玫红色)和开启拉链结构的次要构象(粉红色)b)K6中V467L突变在远离活性中心的α21-螺旋末端引起的主闭合构象(浅灰色)与次闭合构象(紫色)的构象差异。c)K6的次闭合构象中,V467L与L476、V473、L32、A465和L461的疏水相互作用。
版权所有 © 2012- Copyright All Rights Reserved 中国科学院天津工业生物技术研究所 版权所有
通讯地址:天津空港经济区西七道32号,邮编:300308
电话:022-84861997/84861977,传真:022-84861926,邮箱:tib_zh(AT)tib.cas.cn