天津工业生物技术研究所实现大肠杆菌实时动态调控葡萄糖摄取率及中心途径代谢
字号:【大】 【中】 【小】
葡萄糖是工业微生物发酵过程中的主要碳源,其摄取速率直接决定胞内整体代谢通量。葡萄糖通过糖酵解和磷酸戊糖途径代谢,可生成多种目标产物。但在细胞培养中,代谢通量的不平衡常使大量葡萄糖未能转化为目标产物,而是转化为副产物排出。这种低效代谢现象在发酵过程中普遍存在,不仅浪费原料,还导致细胞生长与生产失衡,严重影响目标产物的生产效率。
近日,中国科学院天津工业生物技术研究所张大伟研究员带领的蛋白表达系统与微生物代谢研究团队开发了实时动态监测大肠杆菌葡萄糖吸收速率的方法及其遗传回路,能够动态调节葡萄糖摄取速率及相关代谢途径的碳通量。
在大肠杆菌摄取葡萄糖时,会经历一系列复杂的过程,包括跨膜转运、磷酸化、去磷酸化、辅助蛋白招募,以及相关因子的表达或抑制等。基于此调控机制,研究团队开发出了能够实时响应葡萄糖摄取速率的生物传感器(GURBs)(图1),并建立了对葡萄糖摄取速率和中央代谢流进行正负调节的遗传回路。GURBs的性能和灵敏度在不同条件下得到了验证。在线荧光和离线葡萄糖检测技术表明,GURBs可以直接测量葡萄糖摄取速率。GURBs被应用于氨基酸,维生素,有机酸等产品合成(图2),通过调控中央代谢途径代谢流,或调控遗传回路的激活或抑制,有效的提高了其产量。这些结果表明,GURBs可以根据葡萄糖摄取速率动态调节葡萄糖摄取率,及中央代谢和相关途径的碳通量,从而提高目标产品产量。
葡萄糖作为细胞摄取碳源的第一步,建立其实时监测及动态调控技术十分重要,通过基因回路优化代谢流分配,不仅能很好地适应培养环境变化,还能有效平衡细胞生长与产物合成之间的代谢竞争,合理分配和利用碳资源,为合成生物设计与细胞工厂的构建提供了重要工具和更多选择。
该研究获得国家重点研发计划,国家自然基金委杰出青年科学基金,天津市合成生物提升行动等项目资助。相关成果发表于Nature Chemical Engineering期刊。中国科学院天津工业生物技术研究所博士后丁冬芹和科研助理朱亚如为共同第一作者。中国工程院外籍院士、美国科学院外籍院士、韩国科学技术院院士Sang Yup Lee教授与天津工业生物技术研究所张大伟研究员为共同通讯作者。
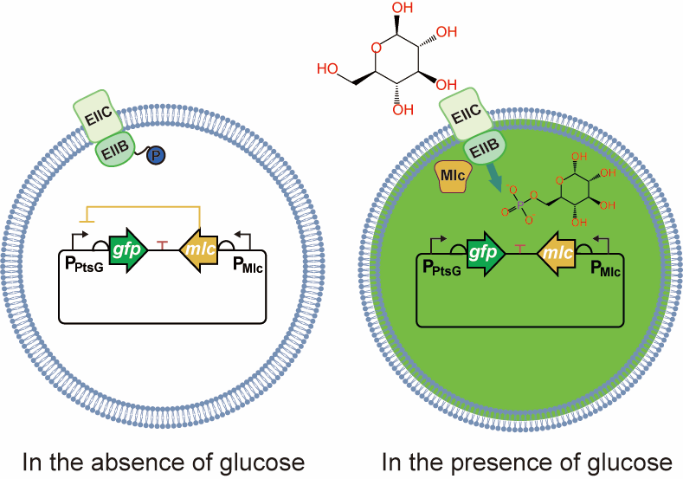
图1 葡萄糖摄取速率生物传感器开发策略的示意图
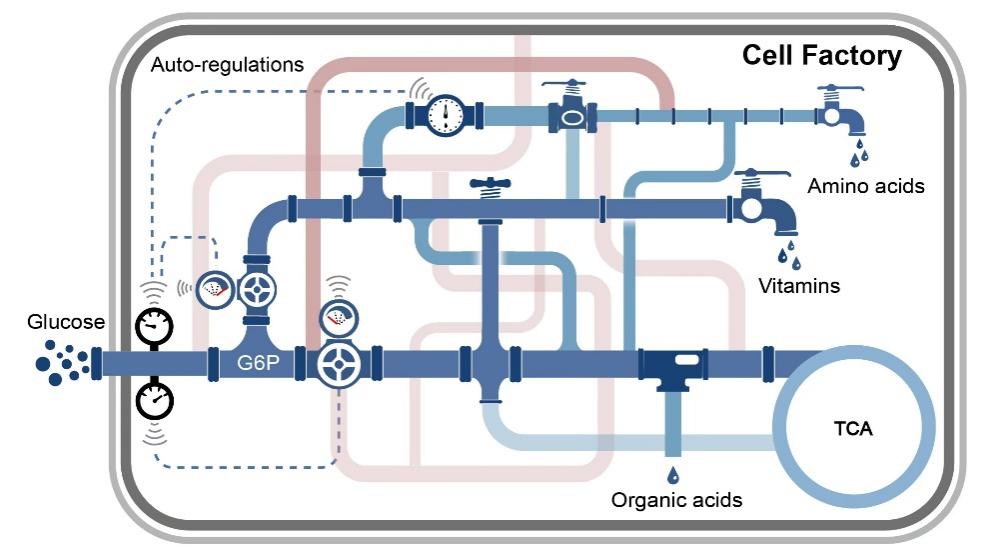
图2 动态调控增强氨基酸、维生素、有机酸的生物合成效率
版权所有 © 2012- Copyright All Rights Reserved 中国科学院天津工业生物技术研究所 版权所有
通讯地址:天津空港经济区西七道32号,邮编:300308
电话:022-84861997/84861977,传真:022-84861926,邮箱:tib_zh(AT)tib.cas.cn